Механизм электромеханического сопряжения теория скольжения роль ионов кальция
Главная / Без рубрики / Механизм электромеханического сопряжения теория скольжения роль ионов кальцияМеханизм мышечных сокращений
Молекулярный механизм мышечного сокращения посредством скольжения актиновых нитей заключается в следующем. Миозиновые головки соединяют протофибриллу с актиновой. При их наклонах происходит скольжение, двигающее актиновую нить к центру саркомера. За счет биполярной организации миозиновых молекул на обеих сторонах нитей создаются условия для скольжения актиновых нитей в разные стороны.
Главным в теории является то, что не нити (миозиновые и актиновые) укорачиваются. Длина их остается неизменной и при растяжении мышц. Но пучки тонких нитей, проскальзывая, выходят между толстыми нитями, уменьшается степень их перекрытия, таким образом происходит сокращение.
Регулирующая роль ионов кальция в мышечном сокращении
Как сказано выше, для возникновения сокращения скелетной мышцы ионы кальция должны поступить к миофибриллам из саркоплазматической сети. Так называют систему пузырьков и цистерн, отделенных мембранами от остальной саркоплазмы (рисунок 6). СПС занимает примерно 10% объема мышечного волокна, а суммарная площадь ее мембран в миоците приблизительно в 100 раз больше поверхности сарколеммы (мембраны саркомеров). СПС служит кальциевым депо в мышечном волокне — содержание в ней ионов кальция огромно. Следовательно, на мембране СПС поддерживается колоссальный градиент Са 2+ , но в покое она совершенно непроницаема для этого иона.
Выход кальция из СПС прекращается сразу вслед за реполяризациией сарколеммы, но миофибриллы пребывают в сокращенном состоянии. Чтобы миофибриллы расслабились, кальции должен обратно вернуться в саркоплазматическую сеть. Но такой транспорт приходится осуществлять вопреки действию огромного концентрационного градиента (в СПС кальция много, в саркоплазме мало). Следовательно, расслабление миофибрилл в миоците скелетных мышц после их сокращения невозможно без участия системы активного транспорта — кальциевой помпы (рисунок 6, В). Ее работа — неотъемлемый элемент сократительного процесса в мышце. Из мембраны СПС выделена Са-активируемая АТФаза, которая служит основным компонентом кальциевого насоса.
Хемомеханический этап мышечного сокращения
В покое, когда ионов Ca мало, скольжения не происходит, потому что этому препятствуют молекулы тропонина и отрицательно заряды АТФ, АТФ-азы и АДФ. Повышенная концентрация ионов Ca происходит за счет поступления его из межфибриллярного пространства. При этом происходит ряд реакций с участием ионов Ca:
Понижение работоспособности изолированной из организма мышцы при ее длительном раздражении обусловлено двумя основными причинами. Первой из них является то, что во время сокращений в мышце накапливаются продукты обмена веществ (фосфорная кислота, связывающая Са++, молочная кислота и др.), оказывающие угнетающее действие на работоспособность мышцы. Часть этих продуктов, а также ионы Са диффундируют из волокон наружу в околоклеточное пространство и оказывают угнетающее действие на способность возбудимой мембраны генерировать ПД. Так, если изолированную мышцу, помещенную в небольшой объем жидкости Рингера, довести до полного утомления, то достаточно только сменить омывающий ее раствор, чтобы восстановились сокращения мышцы.
Механизм мышечного сокращения
Рассчитано, что в каждую миофибриллу, диаметр которой составляет 1 мкм, входит примерно 2500 протофибрилл, то есть удлиненных полимеризованных молекул белков (актина и миозина). Актиновые протофибриллы в два раза тоньше миозиновых. В покое эти мышцы находятся так, что актиновые нити кончиками проникают в промежутки между миозиновыми протофибриллами.
При электронной микроскопии видно, что на боковых сторонах миозиновой нити обнаруживаются выступы, получившие название поперечных мостиков. Они ориентированы по отношению к оси миозиновой нити под углом 120°. Согласно современным представлениям, поперечный мостик состоит из головки и шейки. Головка приобретает выраженную АТФазную активность при связывании с актином. Шейка обладает эластическими свойствами и представляет собой шарнирное соединение, поэтому головка поперечного мостика может поворачиваться вокруг своей оси.
Электромеханическое сопряжение в мышцах
3.Для определения механических свойств костной ткани была взятапластинка из свода черепа со следующими размерами: длина L = 5 см, ширина b = 1 см, толщина h = 0,5 см. Под действием силы F = 200 Н пластинка удлинилась на ∆L = 1,2∙10 -3 см. Определите по этим данным модуль Юнга костной ткани при деформации растяжения.
Таким образом, в кардиомиоците электромеханическое сопряжение идет в две ступени: вначале небольшой входящий поток кальция активирует мембраны СР, способствуя большему выбросу кальция из внутриклеточного депо, а затем в результате этого выброса происходит сокращение саркомера. Заметим, что описанный выше двухступенчатый процесс сопряжения доказан экспериментально.
Электро-механическое сопряжение в сердечной мышце
Этап 2. Гидролиз АТФ. Расщепление АТФ на АДФ и неорганический фосфат (Ф) происходит в головке миозина, продукты гидролиза остаются в миозине. В результате гидролиза головка миозина “распрямляется”, т.е. располагается перпендикулярно или под углом 90 0 относительно толстых и тонких нитей. Это движение приводит к тому, что кончик нити миозина продвигается на 11 нм вдоль нити актина и головка миозина оказывается против нового мономера актина. Если все поперечные мостики находятся в таком состоянии — мышца расслаблена.
2. Сердечные гликозиды. Производные дигиталиса способны ингибировать Na-K насос плазматической мембраны и, следовательно, повышать уровень внутриклеточного Na + ([Na + ]i). В результате происходит замедление Na-Са обмена, повышение уровня [Са 2+ ]i и увеличение сократимости. Недавние исследования выявили новый механизм действия сердечных гликозидов — через увеличение проницаемости Na + -каналов плазматической мембраны для ионов Са 2+.
Нервно-мышечная физиология
Квантовая гипотеза освобождения медиатора. Постсинаптические потенциалы, вызванные раздражением двигательного нерва (потенциалы концевой пластинки — ПКП), от раздражения к раздражению варьируют по амплитуде, причем эти колебания кратны амплитуде МПКП. Было предположено, что медиатор в синапсе освобождается в виде мультимолекулярных порций — квантов. В покое случайное освобождение из нервного окончания отдельных порций вызывает появление на постсинаптической мембране МПКП, а в ответ на раздражение происходит синхронное освобождение нескольких десятков или сот квантов и возникает ПКП. Электрофизиологическое определение показало, что квант медиатора состоит из 1000-10 000 молекул ацетилхолина.
Комедиаторы — это сопутствующие синаптические посредники, характеризующиеся прежде всего совместной локализацией, совместным высвобождением и общей клеткой-мишенью. Под совместной локализацией понимается синтез и депонирование медиаторов в одном и том же нейроне, их происхождение в одних и тех же пресинаптических окончаниях, но не обязательно в одних и тех же пузырьках. Под совместным высвобождением понимается экзоцитоз двух (и более) медиаторов, в результате одной и той же активации пресинаптического окончания, под которым в данном случае подразумевается не одиночный пресинаптический потенциал действия, а разряд потенциалов действия с одной и той же частотой.
Механизм электромеханического сопряжения теория скольжения роль ионов кальция
Такой механизм активации обусловлен действием Са 2+ на тропонин, который работает как «кальциевый переключатель»: при связывании с Са 2+ его молекула деформируется таким образом, что как бы заталкивает тропомиозин в желобок между двумя цепочками актиновых мономеров, т. е. в «активированное положение».
У гладкомышечных клеток веретеновидная форма, длина примерно 50–400 мкм и толщина 2–10 мкм. Соединенные особыми межклеточными контактами (десмосомами), они образуют сеть с вплетенными в нее коллагеновыми волокнами. Из–за нерегулярного распределения миозиновых и актиновых нитей эти клетки лишены поперечной полосатости, характерной для сердечной и скелетной мускулатуры. Они также укорачиваются за счет скольжения миофиламентов относительно друг друга, но скорости скольжения и расщепления АТФ здесь в 100–1000 раз ниже, чем в поперечнополосатых мышцах. В связи с этим гладкие мышцы особенно хорошо приспособлены для длительного устойчивого сокращения, не приводящего к утомлению и значительным энергозатратам. Сократительное напряжение на единицу площади поперечного сечения у гладких и скелетных мышц часто одинаково (30–40 Н/см 2 ), и при длительном сокращении они могут удерживать одинаковую нагрузку. Однако энергия, расходуемая при этом гладкой мышцей, если оценивать по потреблению O 2, в 100–500 раз меньше [18].
Биология и медицина
Отдельную систему составляют поперечные трубочки (T-трубочки) , которые пересекают мышечное волокно на границе A-дисков и I-дисков , проходят между латеральными цистернами двух смежных саркомеров и выходят на поверхность волокна, составляя единое целое с плазматической мембраной. Просвет Т-трубочки заполнен внеклеточной жидкостью, окружающей мышечное волокно. Ее мембрана, как и плазматическая, способна к проведению потенциала действия. Возникнув в плазматической мембране, потенциал действия быстро распространяется по поверхности волокна и мембране Т-трубочек в глубь клетки. Достигнув области Т-трубочек, прилегающих к латеральным цистернам, потенциал действия активирует потенциалзависимые «воротные» белки их мембраны, физически или химически сопряженные с кальциевыми каналами мембраны латеральных цистерн. Таким образом, деполяризация мембраны Т-трубочек. обусловленная потенциалом действия, приводит к открыванию кальциевых каналов мембраны латеральных цистерн, содержащих Са2+ в высокой концентрации, и ионы Са2+ выходят в цитоплазму. Повышение цитоплазматического уровня Са2+ обычно бывает достаточным для активации всех поперечных мостиков мышечного волокна.
Процесс сокращения продолжается, пока ионы Са2+ связаны с тропонином , т.е. до тех пор, пока их концентрация в цитоплазме не вернется к исходному низкому значению. Мембрана саркоплазматического ретикулума содержит Са2+-АТФазу — интегральный белок, осуществляющий активный транспорт Са2+ из цитоплазмы обратно в полость саркоплазматического ретикулума. Са2+ высвобождается из ретикулума в результате распространения потенциала действия по Т-трубочкам ; для его возвращения в ретикулум нужно гораздо больше времени, чем для выхода. Поэтому повышенная концентрация Са2+ в цитоплазме сохраняется в течение некоторого времени и сокращение мышечного волокна продолжается после завершения потенциала действия.
МЕХАНИЗМ СОКРАЩЕНИЯ МЫШЕЧНОГО ВОЛОКНА
3. Происходит процесс электромеханического сопряжения: он представляет собой преобразование электрического потенциала действия в механическое «скольжение» протофибрилл по отношению друг к другу. Этот процесс происходит в несколько этапов с обязательным посредством ионов кальция!
Хранение и высвобождение ионов кальция. В состоянии расслабления мышца содержит более 1 мкмоль Са на 1 г сырого веса. Если бы соли Са не были изолированы в особых внутриклеточных хранилищах, обогащенные кальцием мышечные волокна находились бы в состоянии непрерывного сокращения. Структура внутриклеточных систем хранения кальция следующая: во многих участках мембрана мышечной клетки углубляется внутрь волокна, перпендикулярно его продольной оси, образуя трубки; эта система поперечных трубочек
urist-yslugi.ru
Механизм электромеханического сопряжения (теория мышечного сокращения).
В покоящейся мышце места связывания для миозина на актине замаскированы, и миозин находится в высокоэнергетическом конформационном состоянии (М *). Энергия гидролиза АТФ необходима, чтобы перевести миозин из низкоэнергетического (М) в высокоэнергетическое состояние. Это иллюстрирует уравнение 1:
(М-АТФ) (М*-АДФ-Фн) Уравнение 1
Когда в цитозоле увеличивается концентрация кальция, и места связывания миозина на актине демаскируются, — формируется актомиозиновый комплекс. Впоследствии от комплекса последовательно отщепляются Фни АДФ, а миозин переходит в низкоэнергетическое состояние (уравнение 2,3). При этом происходит перемещение соответствующей тонкой нити к М-линии саркомера.
(М*-АДФ-Фн) + А (М*-АДФ-А) + Ф
(М*-АДФ-А) (М-А) + АДФ Уравнение 3
Этапы, приведенные в уравнениях 2 и 3, составляют молекулярный механизм движущей силы мышечного сокращения. Ещё раз подчеркнем, что источником энергии для этой движущей силы является АТФ. Гидролиз нуклеотида опосредует превращение низкоэнергетического конформационного состояния миозина в высокоэнергетическое. Актомиозиновый комплекс существует до тех пор, пока не происходит связывание АТФ. Присоединение АТФ к миозину — это экзергоническая реакция, результатом которой является отход головки миозина от актина (уравнение 4). То есть, АТФ необходим для мышечного расслабления, а в расслабленной мышце миозин находится в высокоэнергетическом конформационном состоянии. То, что конечный продукт уравнения 4 (М-АТФ) является первым участником уравнения 1, свидетельствует о том, что именно в этом месте завершается цикл сокращения.
(МА) + АТФ (М-АТФ) + А Уравнение 4
Схематическое изображение реакций, приведенных в уравнениях 1-4, в том виде, в котором они происходят в мышцах, показано на рис.7.11.
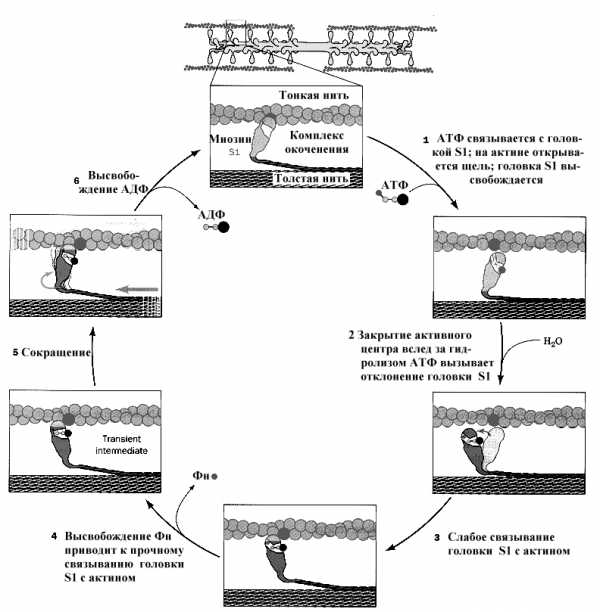
Рис. 17.11.Гидролиз АТФ управляет работой цикла ассоциации-диссоциации актина и миозина
Регуляция саркоплазматического кальция
Стимуляция мышечной активности за счет роста саркоплазматического кальция начинается с передачи нервного возбуждения на уровне нервно-мышечных синапсов. Возбуждение вызывает деполяризацию сарколеммы, распространяющуюся на ассоциированную Т-тубулярную систему и глубоко внутрь мышечного волокна. В свою очередь, деполяризация Т-тубулы распространяется на саркоплазматический ретикулум (СР), в результате в мембранах СР открываются потенциало-зависимые ворота кальциевых каналов. Из них кальций устремляется в саркоплазму, близко к миофибриллам. Присутствие кальция в непосредственной близости к тропонину С (одной из субъединиц тропонина) приводит к перемещению миозина. Такое явление сохраняется до тех пор, пока концентрация кальция в этом месте превышает 1 микромоль.
Мышечное расслаблениеМеханизм расслабления. Роль атф-аз, атф.
В норме прекращение сократительной активности и развитие состояния расслабления наступает вслед за исчезновением электрическоой активности в нервно-мышечном синапсе. Саркоплазматическая мембрана возвращается к потенциалу покоя (снаружи заряд более положительный, разница — 60 мв,). То же самое происходит во всей Т-тубулярной системе и мембране саркоплазматического ретикулума (СР). Затем саркоплазматический кальций закачивается обратно в цистерны СР посредством исключительно активного АТФ-зависимого кальциевого насоса. Са 2+-АТФаза является одним из основных белков мембраны СР. За счет гидролиза каждой молекулы АТФ из саркоплазмы выводятся два иона кальция. Таким образом концентрация саркоплазматического кальция падает до 0,1 мкмоль и ниже, что в 50-100 раз меньше того уровня, который требуется для присоединения кальция к тропонину-С.
В мембране эндоплазматического ретикулума, в области цистерн, содержится большое количество гликопротеина — кальсеквестрина. Кальсеквестрин жадно связывает кальций, уменьшая его концентрацию в цистерне. Это благоприятствует аккумуляции кальция. Ещё одним местом накопления саркоплазматического кальция является митохондриальный матрикс. У митохондрий имеется активный кальциевый насос, работа которого зависит от хемиосмотического потенциала, формирующегося за счет транспорта электронов. В аэробных условиях этот насос использует энергию транспорта электронов для закачки кальция в митохондриальный матрикс. Этот процесс идет даже в ущерб синтезу АТФ.
studfiles.net
Электромеханическое сопряжение волокон скелетных мышц
Электромеханическое сопряжение волокон скелетных мышц
Электромеханическое сопряжение — это последовательность процессов, в результате которых потенциал действия плазматической мембраны мышечного волокна приводит к запуску цикла поперечных мостиков . Плазматическая мембрана скелетных мышц электрически возбудима и способна генерировать распространяющийся потенциал действия посредством механизма, аналогичного тому, который действует в нервных клетках (см. « Проведение возбуждения между клетками «. Потенциал действия в волокне скелетной мышцы длится 1-2 мс и заканчивается раньше, чем появятся какие-либо признаки механической активности ( рис. 30.14 ). Начавшаяся механическая активность может продолжаться более 100 мс. Электрическая активность плазматической мембраны не оказывает прямого влияния на сократительные белки, а вызывает повышение цитоплазматической концентрации ионов Са2+, которые продолжают активировать сократительный аппарат и после прекращения электрического процесса.
В состоянии покоя в мышечном волокне концентрация свободного ионизированного Са2+ в цитоплазме вокруг толстых и тонких филаментов очень низка, около одной десятимиллионной доли моля/л. При такой низкой концентрации ионы Са2+ занимают очень небольшое количество участков связывания на молекулах тропонина, поэтому тропомиозин блокирует активность поперечных мостиков . После потенциала действия концентрация ионов Са2+ в цитоплазме быстро возрастает, и они связываются с тропонином , устраняя блокирующий эффект тропомиозина и инициируя цикл поперечных мостиков. Источником поступления Са2+ в цитоплазму является саркоплазматический ретикулум мышечного волокна.
Саркоплазматический ретикулум мышц гомологичен эндоплазматическому ретикулуму других клеток. Он располагается вокруг каждой миофибриллы наподобие «рваного рукава», сегментами которого окружены A-диски и I-диски ( рис. 30.15 ). Концевые части каждого сегмента расширяются в виде так называемых латеральных цистерн , соединенных друг с другом серией более тонких трубок. В латеральных цистернах депонируется Са2+; после возбуждения плазматической мембраны он высвобождается.
Отдельную систему составляют поперечные трубочки (T-трубочки) , которые пересекают мышечное волокно на границе A-дисков и I-дисков , проходят между латеральными цистернами двух смежных саркомеров и выходят на поверхность волокна, составляя единое целое с плазматической мембраной. Просвет Т-трубочки заполнен внеклеточной жидкостью, окружающей мышечное волокно. Ее мембрана, как и плазматическая, способна к проведению потенциала действия. Возникнув в плазматической мембране, потенциал действия быстро распространяется по поверхности волокна и мембране Т-трубочек в глубь клетки. Достигнув области Т-трубочек, прилегающих к латеральным цистернам, потенциал действия активирует потенциалзависимые «воротные» белки их мембраны, физически или химически сопряженные с кальциевыми каналами мембраны латеральных цистерн. Таким образом, деполяризация мембраны Т-трубочек. обусловленная потенциалом действия, приводит к открыванию кальциевых каналов мембраны латеральных цистерн, содержащих Са2+ в высокой концентрации, и ионы Са2+ выходят в цитоплазму. Повышение цитоплазматического уровня Са2+ обычно бывает достаточным для активации всех поперечных мостиков мышечного волокна.
Процесс сокращения продолжается, пока ионы Са2+ связаны с тропонином , т.е. до тех пор, пока их концентрация в цитоплазме не вернется к исходному низкому значению. Мембрана саркоплазматического ретикулума содержит Са2+-АТФазу — интегральный белок, осуществляющий активный транспорт Са2+ из цитоплазмы обратно в полость саркоплазматического ретикулума. Са2+ высвобождается из ретикулума в результате распространения потенциала действия по Т-трубочкам ; для его возвращения в ретикулум нужно гораздо больше времени, чем для выхода. Поэтому повышенная концентрация Са2+ в цитоплазме сохраняется в течение некоторого времени и сокращение мышечного волокна продолжается после завершения потенциала действия.
Подведем итог. Сокращение обусловлено высвобождением ионов Са2+, хранящихся в саркоплазматическом ретикулуме; когда Са2+ поступает обратно в ретикулум, сокращение заканчивается и начинается расслабление ( рис. 30.16 ). Источником энергии для кальциевого насоса служит АТФ — это одна из трех его главных функций в мышечном сокращении ( табл. 30.1 ).
Ссылки:
medbiol.ru
4. Электромеханическое сопряжение
Связь между возбуждением и сокращением мышечного волокна описана А.Хаксли (1959). Осуществляется при помощи системы поперечных трубочек поверхностной мембраны (Т-системы) и внутриволоконного саркоплазматического ретикулума. Деполяризация, вызываемая потенциалом действия, распространяется на Т — систему и стимулирует освобождение ионов кальция из полостей ретикулума. Взаимодействие ионов кальция с регуляторным белком тропонином С приводит к активации системы сократительных белков актина и миозина. Механизм генерации потенциала действия принципиально не отличается от этого процесса в нейроне. Скорость его распространения по мембране мышечного волокна 3 — 5 м/c.
5. Режимы и виды сокращения мышц
Режимы сокращения мышцы: изотонический (когда мышца укорачивается при неизменном внутреннем напряжении, например, при нулевой массе поднимаемого груза) и изометрический (при этом режиме мышца не укорачивается, а лишь развивает внутреннее напряжение, что бывает при нагрузке неподъёмным грузом). Ауксотонический режим — при сокращении мышцы с нагрузкой вначале в мышце возрастает напряжение без укорочения (изометрический режим), затем, когда напряжение преодолевает массу поднимаемого груза, укорочение мышцы происходит без дальнейшего роста напряжения (изотонический режим).
Различают виды сокращений: одиночное и тетаническое. Одиночное сокращение возникает при действии на мышцу одиночного нервного импульса или однократного толчка тока. В миоплазме мышцы происходит кратковременный подъём концентрации кальция, сопровождаемый кратковременной работой — тягой миозиновых мостиков, сменяющейся покоем. В изометрическом режиме одиночное напряжение начинается через 2 мс после развития потенциала действия, причём напряжению предшествует кратковременное и незначительное латентное расслабление.
Тетанус — это сложное сокращение, возникающее при стимуляции с частотой выше, чем длительность одиночного мышечного сокращения. Тетанус бывает зубчатый, если мышца совершает незначительные колебания на высоте амплитуды сокращения, и гладкий — при постоянном во времени сокращении. При относительно малой частоте раздражений возникает зубчатый тетанус, при большой частоте — гладкий тетанус. Чем быстрее сокращаются и расслабляются волокна мышцы, тем чаще должны быть раздражения, чтобы вызвать тетанус.
В естественных условиях мышечные волокна работают в режиме одиночного сокращения только тогда, когда длительность интервала между разрядами мотонейронов равна или превышает длительность одиночного сокращения иннервируемых данным мотонейроном мышечных волокон. В режиме одиночного сокращения мышца способна работать длительное время без утомления, совершая при этом минимальную работу. При увеличении частоты разрядов развивается тетаническое сокращение. При зубчатом тетанусе происходит непрерывное нарастание силы сокращения и выполняемой работы. Во время гладкого тетануса мышечное напряжение не изменяется, а поддерживается на достигнутом уровне. В таком режиме мышца человека работает при развитии максимальных изометрических усилий. Работа мышцы (А) измеряется произведением массы груза (Р) и расстояния (H), на которое этот груз перемещается.
Работа может быть динамической (преобладают изотонические режимы сокращения) или статической. Она может быть преодолевающей и уступающей.
Расслабление мышцы.
Восстановление потенциала покоя мембраны прекращает поступление из саркоплазматического ретикулума ионов кальция и дальнейший сократительный процесс. Кальций в миоплазме активирует Са-АТФ-азу, кальциевый насос осуществляет активный перенос этого иона в саркоплазматический ретикулум. Возврат мышцы в исходное, растянутое положение определяется массой костей скелета, связанных с данными мышцами и создающими растягивающее усилие после прекращения процесса сокращения. Вторым моментом является упругость мышцы, которая преодолевается в момент сокращения. Структурной основой упругости мышцы являются:
Поперечные мостики.
Z — диски.
Участки прикрепления концов миофибрилл к сухожильным элементам мышечного волокна.
Наружные соединительнотканные элементы мышцы и её волокна.
Места прикрепления мышц к костям.
Продольная система саркоплазматического ретикулума.
Сарколемма мышечного волокна.
Капиллярная сосудистая сеть мышцы.
studfiles.net
Электромеханическое сопряжение
| [15] |
| Совокупность явлений, обусловливающих связь между возбуждением (потенциалом действия) и сокращением мышечных волокон. |
| Имеет разные названия: «электромеханическая связь», или «электромеханическое сопряжение» (ЭМС[Мф24] ), «электромеханический каплинг[Мф25] », связь «возбуждение — сокращение», «мембранно-миофибриллярная связь[Мф26] », этапы генерирования сокращения[Мф27] . |
Электромеханическое сопряжение при сокращении скелетного миоцита
Под электромеханическим сопряжением[l] понимают процесс преобразования электрического сигнала в химический, а затем в мышечное сокращение.
Расположение структур, обеспечивающих передачу электрического сигнала сокращение в мышечном волокне, строго упорядочены (рис. 709270643).
| Рис. 709270643. Схема организации саркоплазматического ретикулума, Т‑трубочек и миофибрилл в мышечном волокне. 1 – сарколемма, 2 – триада, 3 — митохондрия, 4 – миофибриллы, 5 — саркоплазматический ретикулум (САР), 6 – терминальные цистерны САР |
К регулярно расположенным Т‑трубочкам с двух сторон подходят терминальные цистерны саркоплазматического ретикулума (САР).
Т‑трубочка и расположенные с двух сторон от неё цистерны образуют триаду.
Z‑мембраны и зоны перекрытия актиновых и миозиновых нитей расположены рядом с триадами.
Такая структура необходима для эффективного электромеханического сопряжения.
Электромеханическое сопряжение включает следующие процессы (рис. 709240356):
| Рис. 709240356. Схема электромеханического сопряжения. |
| 1. Образование потенциала концевой пластинки (ПКП). 2. Электротоническое распространение ПКП в околосинаптическую область. 3. Генерация потенциала действия мышечного волокна в околосинаптической области. 4. Распространение потенциала действия по поверхностной мембране мышечного волокна 5. Распространение потенциала действия по мембранам поперечных трубочек (Т‑системы). 6. Реакция рецепторов дигидропиридина [m] на изменение мембранного потенциала. 7. Передача сигнала дигидропиридиновыми рецепторами рианодиновым рецепторам терминальных цистерн саркоплазматического ретикулума. 8. Открытие каналов Ca2+, с рианодиновыми рецепторами и выход Ca2+ из саркоплазматического ретикулюма (цистерн) в саркоплазму[Мф28] (цитозоль). 9. Диффузия Ca2+ в межфибриллярное пространство. 10. Связывание Ca2+ с тропонином, расположенным на тонком, актиновом, миофиламенте. 11. Конформационные изменения тропонина[Мф29] при связывании Са2+ ® «заталкивание» тропомиозина в канавки актиновых нитей (рис. 210201735). |
| Рис. 709240358. Механизм открытия активного центра актиновых нитей для миозиновых головок при связывании тропонином 4 ионов Ca2+. |
| Этапы электромеханического сопряжения (продолжение) 12. Открытие активного центра актиновых нитей. 13. Соединение головки миозина, каталитический центр которого связан с АДФ и фосфатом (продуктами гидролиза АТФ[Мф30] ). 14. Начинается цикл миозиновых мостиков. |
Рис. 210201735 показывает механизм открытия активного центра актиновых нитей без деталей и может быть использован студентом при ответе.
| Рис. 210201735. Механизм открытия активного центра актиновых нитей для миозиновых головок при связывании тропонином Ca2+. |
Иногда электромеханическое сопряжение разбивают на 2 этапа – электрохимическое сопряжение от образования ПКП до выделения Ca2+ САР и хемомеханическое сопряжение от выделения Ca2+ САР до цикла миозиновых головок.
Особенности электромеханического сопряжение при сокращении сердечного миоцита
| У миокардиоцита значительное колличество Ca2+ в цитозроль поступает из интерстиция (рис. 709270937). Рис. 709270937. Пути поступления Ca2+ в цитозоль у разных типов миоцитов при сокращении. |
Рианодиновые рецепторы, расположенные на мембране саркоплазматического ретикулума, активируются входящим из межклеточного вещества Ca2[Мф31] +.[n]
Кофеин также оказывает на эти рецепторы активирующее действие[Мф32] .
infopedia.su
4. Электромеханическое сопряжение
Связь между возбуждением и сокращением мышечного волокна описана А.Хаксли (1959). Осуществляется при помощи системы поперечных трубочек поверхностной мембраны (Т-системы) и внутриволоконного саркоплазматического ретикулума. Деполяризация, вызываемая потенциалом действия, распространяется на Т — систему и стимулирует освобождение ионов кальция из полостей ретикулума. Взаимодействие ионов кальция с регуляторным белком тропонином С приводит к активации системы сократительных белков актина и миозина. Механизм генерации потенциала действия принципиально не отличается от этого процесса в нейроне. Скорость его распространения по мембране мышечного волокна 3 — 5 м/c.
5. Режимы и виды сокращения мышц
Режимы сокращения мышцы: изотонический (когда мышца укорачивается при неизменном внутреннем напряжении, например, при нулевой массе поднимаемого груза) и изометрический (при этом режиме мышца не укорачивается, а лишь развивает внутреннее напряжение, что бывает при нагрузке неподъёмным грузом). Ауксотонический режим — при сокращении мышцы с нагрузкой вначале в мышце возрастает напряжение без укорочения (изометрический режим), затем, когда напряжение преодолевает массу поднимаемого груза, укорочение мышцы происходит без дальнейшего роста напряжения (изотонический режим).
Различают виды сокращений: одиночное и тетаническое. Одиночное сокращение возникает при действии на мышцу одиночного нервного импульса или однократного толчка тока. В миоплазме мышцы происходит кратковременный подъём концентрации кальция, сопровождаемый кратковременной работой — тягой миозиновых мостиков, сменяющейся покоем. В изометрическом режиме одиночное напряжение начинается через 2 мс после развития потенциала действия, причём напряжению предшествует кратковременное и незначительное латентное расслабление.
Тетанус — это сложное сокращение, возникающее при стимуляции с частотой выше, чем длительность одиночного мышечного сокращения. Тетанус бывает зубчатый, если мышца совершает незначительные колебания на высоте амплитуды сокращения, и гладкий — при постоянном во времени сокращении. При относительно малой частоте раздражений возникает зубчатый тетанус, при большой частоте — гладкий тетанус. Чем быстрее сокращаются и расслабляются волокна мышцы, тем чаще должны быть раздражения, чтобы вызвать тетанус.
В естественных условиях мышечные волокна работают в режиме одиночного сокращения только тогда, когда длительность интервала между разрядами мотонейронов равна или превышает длительность одиночного сокращения иннервируемых данным мотонейроном мышечных волокон. В режиме одиночного сокращения мышца способна работать длительное время без утомления, совершая при этом минимальную работу. При увеличении частоты разрядов развивается тетаническое сокращение. При зубчатом тетанусе происходит непрерывное нарастание силы сокращения и выполняемой работы. Во время гладкого тетануса мышечное напряжение не изменяется, а поддерживается на достигнутом уровне. В таком режиме мышца человека работает при развитии максимальных изометрических усилий. Работа мышцы (А) измеряется произведением массы груза (Р) и расстояния (H), на которое этот груз перемещается.
Работа может быть динамической (преобладают изотонические режимы сокращения) или статической. Она может быть преодолевающей и уступающей.
Расслабление мышцы.
Восстановление потенциала покоя мембраны прекращает поступление из саркоплазматического ретикулума ионов кальция и дальнейший сократительный процесс. Кальций в миоплазме активирует Са-АТФ-азу, кальциевый насос осуществляет активный перенос этого иона в саркоплазматический ретикулум. Возврат мышцы в исходное, растянутое положение определяется массой костей скелета, связанных с данными мышцами и создающими растягивающее усилие после прекращения процесса сокращения. Вторым моментом является упругость мышцы, которая преодолевается в момент сокращения. Структурной основой упругости мышцы являются:
Поперечные мостики.
Z — диски.
Участки прикрепления концов миофибрилл к сухожильным элементам мышечного волокна.
Наружные соединительнотканные элементы мышцы и её волокна.
Места прикрепления мышц к костям.
Продольная система саркоплазматического ретикулума.
Сарколемма мышечного волокна.
Капиллярная сосудистая сеть мышцы.
studfiles.net
Электромеханическое сопряжение при сокращении скелетного миоцита
Под электромеханическим сопряжением[l] понимают процесс преобразования электрического сигнала в химический, а затем в мышечное сокращение.
Расположение структур, обеспечивающих передачу электрического сигнала сокращение в мышечном волокне, строго упорядочены (рис. 709270643).
| Рис. 709270643. Схема организации саркоплазматического ретикулума, Т‑трубочек и миофибрилл в мышечном волокне. 1 – сарколемма, 2 – триада, 3 — митохондрия, 4 – миофибриллы, 5 — саркоплазматический ретикулум (САР), 6 – терминальные цистерны САР |
К регулярно расположенным Т‑трубочкам с двух сторон подходят терминальные цистерны саркоплазматического ретикулума (САР).
Т‑трубочка и расположенные с двух сторон от неё цистерны образуют триаду.
Z‑мембраны и зоны перекрытия актиновых и миозиновых нитей расположены рядом с триадами.
Такая структура необходима для эффективного электромеханического сопряжения.
Электромеханическое сопряжение включает следующие процессы (рис. 709240356):
| Рис. 709240356. Схема электромеханического сопряжения. |
| 1. Образование потенциала концевой пластинки (ПКП). 2. Электротоническое распространение ПКП в околосинаптическую область. 3. Генерация потенциала действия мышечного волокна в околосинаптической области. 4. Распространение потенциала действия по поверхностной мембране мышечного волокна 5. Распространение потенциала действия по мембранам поперечных трубочек (Т‑системы). 6. Реакция рецепторов дигидропиридина [m] на изменение мембранного потенциала. 7. Передача сигнала дигидропиридиновыми рецепторами рианодиновым рецепторам терминальных цистерн саркоплазматического ретикулума. 8. Открытие каналов Ca2+, с рианодиновыми рецепторами и выход Ca2+ из саркоплазматического ретикулюма (цистерн) в саркоплазму[Мф28] (цитозоль). 9. Диффузия Ca2+ в межфибриллярное пространство. 10. Связывание Ca2+ с тропонином, расположенным на тонком, актиновом, миофиламенте. 11. Конформационные изменения тропонина[Мф29] при связывании Са2+ ® «заталкивание» тропомиозина в канавки актиновых нитей (рис. 210201735). |
| Рис. 709240358. Механизм открытия активного центра актиновых нитей для миозиновых головок при связывании тропонином 4 ионов Ca2+. |
| Этапы электромеханического сопряжения (продолжение) 12. Открытие активного центра актиновых нитей. 13. Соединение головки миозина, каталитический центр которого связан с АДФ и фосфатом (продуктами гидролиза АТФ[Мф30] ). 14. Начинается цикл миозиновых мостиков. |
Рис. 210201735 показывает механизм открытия активного центра актиновых нитей без деталей и может быть использован студентом при ответе.
| Рис. 210201735. Механизм открытия активного центра актиновых нитей для миозиновых головок при связывании тропонином Ca2+. |
Иногда электромеханическое сопряжение разбивают на 2 этапа – электрохимическое сопряжение от образования ПКП до выделения Ca2+ САР и хемомеханическое сопряжение от выделения Ca2+ САР до цикла миозиновых головок.
megaobuchalka.ru